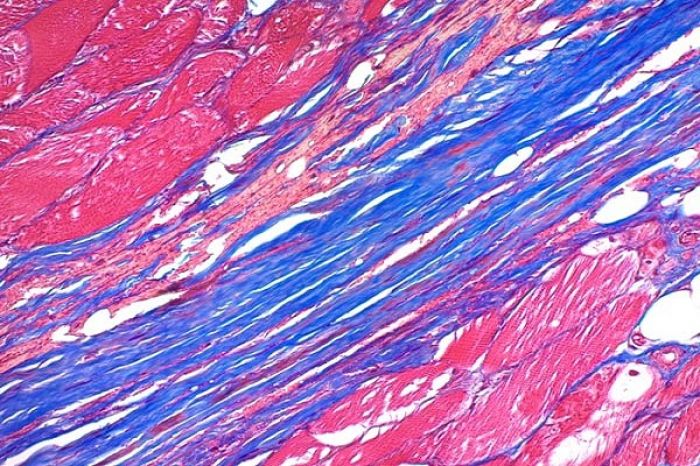
رنگ آمیزی تری کروم ماسون
از روش رنگ آمیزی تری کروم ماسون برای شناسایی رشته های کلاژن در بافت هایی مانند پوست، قلب و ... استفاده می شود و بر اساس تثبیت بافت در فرمالین و برش با میکروتوم بافت قالب گیری شده در پارافین و یا برش بافت منجمد با دستگاه فروزن سکشن کاربرد دارد. در رنگ آمیزی تری کروم رشته های کلاژن به رنگ آبی و هسته سلول به رنگ آبی تیره (بنفش) در یک زمینه قرمز رنگ مشاهده می شود. نمونه های مورد استفاده در رنگ آمیزی تری کروم ماسون بهتر است با محلول ثبوتی فرمالین 10 درصد تثبیت شده باشند اما با محلول های ثبوتی معمول دیگر نیز قابل انجام است. برش های بافت پارافینی با ضخامت 5 میکرون برای این رنگ آمیزی مناسب می باشد.
روش رنگ آمیزی تری کروم ماسون
وایگر هماتوکسیلین A+B به نسبت مساوی 10 دقیقه -----> شستشو -----> اسیدفوشین 6- 5 دقیقه -----> شستشو -----> اسید فسفو مولیبدیک -----> بدون شستشو مایع رویی خالی شود -----> آنیلین بلو 10-5 دقیقه -----> شستشو -----> اسیداستیک 1% 1 دقیقه -----> آبگیری در الکل های افزاینده -----> گزیلل -----> مانت
رنگ آمیزی با محلول هماتوکسیلین آهن وایگرت به مدت 30-20 دقیقه
شستشو در آب جاری
در محلول 1 درصد اسید الکل دیفرانسیه (تمایز رنگ) شود.
شستشو در آب تا بافت آبی شود.
محلول پونسو فوشین به مدت 5-1 دقیقه
شستشو در آب اسید
محلول فسفو تنگستیک فسفو مولیبدیک تا رشته های کلاژن صورتی کمرنگ شوند (10 دقیقه)
شستشو در آب اسید
محلول لایت گرین یا محلول آنیلین بلو به مدت 5-2 دقیقه
(اگر از محلول لایت گرین استفاده شود کلاژن، موسین و غضروف سبز و اگر از آنیلین بلو استفاده شود به رنگ آبی در می آید.)
شستشو در آب اسید
آبگیری، شفاف سازی و چسباندن لامل
در برخی منابع به جای پونسو فوشین از محلول اسکارلت فوشین بای بریچ استفاده می شود که فرمول تهیه آن به شرح زیر است:
محلول آبی 1 درصد اسکارلت 90 میلی لیتر
محلول آبی 1 درصد اسید فوشین 10 میلی لیتر
اسید استیک گلاسیال 1 میلی لیتر
نتیجه رنگ آمیزی تری کروم ماسون
هسته آبی تیره (بنفش)
سیتوپلاسم قرمز روشن
عضله قرمز تیره
فیبرین وهیالین قرمز شفاف
غضروف، کلاژن و موسین آبی تا سبز
طرز ساخت وایگر هماتوکسیلین A: یک گرم هماتوکسیلین + 100 میلی لیتر الکل 96%
طرز ساخت وایگرهماتوکسیلین B: چهار میلی لیتر محلول کلروفریک 29% (29 میلی لیتر کلروفریک + 71 میلی لیتر آب مقطر) + 1 میلی لیتر اسید کلریدریک 37% + 95 میلی لیتر آب مقطر
طرز ساخت اسید فوشین: 0.5 گرم اسید فوشین + 0.5 میلی لیتر اسید استیک گلاسیال + 100 میلی لیتر آب مقطر
طرز ساخت اسید فسفو مولیبدیک: 1 گرم اسید فسفو مولیبدیک + 100 میلی لیتر آب مقطر
طرز ساخت آنیلین بلو: 2 گرم انیلین بلو + 2.5 میلی لیتر اسید استیک گلاسیال + 100 میلی لیتر آب مقطر
Trichrome staining
Trichrome staining is a histological staining method that uses two or more acid dyes in conjunction with a polyacid. Staining differentiates tissues by tinting them in contrasting colours. It increases the contrast of microscopic features in cells and tissues, which makes them easier to see when viewed through a microscope.
The word trichrome means "three colours". The first staining protocol that was described as "trichrome" was Mallory's trichrome stain, which differentially stained erythrocytes to an orange colour, muscle tissue to a red colour, and collagen to a blue colour. Some other trichrome staining protocols are the Masson's trichrome stain, Lillie's trichrome, and the Gömöri trichrome stain.
Trichrome Stains (Masson) are intended for use in the study of connective tissue, muscle and collagen fibers. Trichrome Stain reagents are for In Vitro Diagnostic use. Trichrome stains are used primarily for distinguishing collagen from muscle tissue. In general, they consist of nuclear, collagenous and cytoplasmic dyes in mordants such as phosphotungstic or phosphomolybdic acid. Historically, the first trichrome system wasattributed to Mallory. Further modifications were introduced by Masson and Gomori. The procedure described here is based on the work of Masson as modified by using aniline blue as a collagen stain instead of a green dye. Tissue sections are treated with Bouin’s solution to intensify the final coloration. Nuclei are stained with Weigert’s iron hematoxylin, and cytoplasm and muscle are then stained with Beibrich scarlet-acid fuchsin. After treatment with phosphotungstic and phosphomolybdic acid, collagen is demonstrated by staining with aniline blue. Rinsing in acetic acid after staining renders the shades of color more delicate and transparent. Included is a trichrome stain technique forrapid staining in microwave ovens.
Purpose
Without trichome staining, discerning one feature from another can be extremely difficult. Smooth muscle tissue, for example, is hard to differentiate from collagen. A trichrome stain can colour the muscle tissue red, and the collagen fibres green or blue. Liver biopsies may have fine collagen fibres between the liver cells, and the amount of collagen may be estimated based on the staining method. Trichrome methods are now used for differentiating muscle from collagen, pituitary alpha cells from beta cells, fibrin from collagen, and mitochondria in fresh frozen muscle sections, among other applications. It helps in identifying increases in collagenous tissue (i.e., fibrotic changes) such as in liver cirrhosis and distinguishing tumours arising from muscle cells and fibroblasts.[1]
Procedure
Trichrome staining techniques employ two or more acid dyes. Normally acid dyes would stain the same basic proteins, but by applying them sequentially the staining pattern can be manipulated. A polyacid (such as phosphomolybdic acid or tungstophosphoric acid) is used to remove dye selectively. Polyacids are thought to behave as dyes with a high molecular weight: they displace easily removed dye from collagen.
Usually a red dye in dilute acetic acid is applied first to overstain all components. Then a polyacid is applied to remove the red dye from collagen and some other components by displacement. A second acid dye (blue or green) in dilute acetic acid is applied which, in turn, displaces the polyacid, resulting in collagen stained in a contrasting colour to the initial dye used. If erythrocytes are to be stained, a small molecular weight yellow or orange dye is applied before staining with the red dye. It is usually applied from a saturated solution in 80% ethanol and often in conjunction with picric acid (itself a dye) and a polyacid. The methods exploit minor differences in tissue reaction to dyes, density, accessibility and so on.
Trichrome stains in which dyes and a polyacid are applied sequentially are called multi-step trichromes. In "one-step" methods, all the dyes—with or without a polyacid—are combined in a single solution. One of the oldest single-step approaches to trichrome staining is van Gieson's method, which stains muscle and cytoplasm yellow, and collagen red. Another is the Gömöri trichrome stain, which closely mimics Masson's trichrome. In "yellowsolve" methods, a red dye in dilute acetic acid is first applied, then the section is very thoroughly dehydrated to ensure that no moisture remains. The red dye is then displaced by a yellow dye in a solvent, such as cellosolve (2-ethoxy-ethanol). The name yellowsolve is a blend of the terms yellow and cellosolve. Lendrum's phloxine-tartrazine for cell inclusions is one example of a yellowsolve stain.
Dyes
Among the dyes used for trichrome staining are:
Red
Acid fuchsin, xylidine ponceau, chromotrope 2R, Biebrich scarlet, ponceau 6R, phloxine
Blue and green
Light green SF yellowish, Fast Green FCF, methyl blue, water blue
Yellow
Picric acid, orange G, Martius yellow, tartrazine, milling yellow